Surgical Treatment of Pyoderma Gangrenosum with Negative Pressure Wound Therapy and Dermal Substitutes: A Case Report
Article information
Abstract
Pyoderma gangrenosum is a rare ulcerative skin lesion that occurs primarily on the lower extremities for which surgical debridement and skin grafting have been traditionally contraindicated. However, recent literature has reported favorable results from surgical treatment of lesions with adequate immunosuppressive therapy. We report a case of pyoderma gangrenosum with a local infection in a 58-year-old man’s leg that showed improvement in symptoms within a relatively short period, through surgical treatment using negative pressure wound therapy and a dermal substitute. The authors report this case with a literature review.
서론
괴저고름피부증(pyoderma gangrenosum)은 통증을 동반하는 궤양성 피부 병변으로, 주로 전신 질환과 관련되어 드물게 발생한다[1]. 괴저고름피부증의 치료에서는 이상초과민 현상(pathergy phenomenon)으로 인해 외과적 절제술이나 피부 이식술은 전통적으로 금기시되어 왔다[2]. 하지만 최근에는 충분한 면역 억제 치료를 수반하는 외과적 치료를 통한 긍정적인 결과와 이점이 몇몇 연구에서 제시되었다[3]. 특히, 병변이 넓게 퍼지거나 감염 등의 합병증이 동반된 경우, 수술적 치료가 필요할 수 있다. 저자들은 음압 창상 치료와 진피 대체제를 이용한 외과적 치료로 국소 감염이 동반된 하지 전방의 넓은 괴저고름피부증 병변의 증상을 비교적 단기간에 호전시킨 증례를 문헌 고찰과 함께 보고하고자 한다. 본 증례는 인제대 소속기관 생명윤리위원회의 승인 하에 진행되었으며(IRB No. 2022-02-007), 환자는 해당 임상 사진 게시 및 사용에 대해 충분한 설명 들은 후 사전 동의하였다.
증례
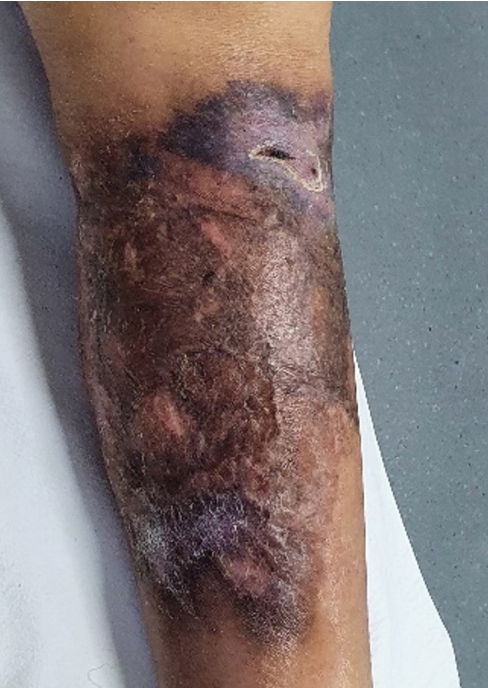
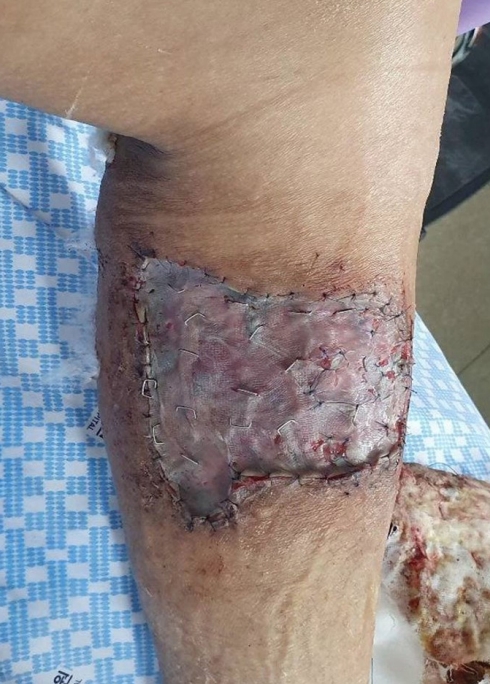
기저 질환이 없는 58세 남자가 가벼운 외상으로 좌측 하지 전경골 부위에 2×2 cm 크기의 창상을 수상하였다. 이후에 시간이 지나도 창상이 치유되지 않고 지속적으로 면적이 넓어지며 통증이 악화되어 지역 병원을 방문하였다. 지역 병원에서는 연부 조직 감염의 가능성을 의심하여 경험적 항생제를 투여하며 병변에 대해 변연절제술과 부분적 봉합을 시행하였다(Fig. 1). 창상 부위에서 실시한 세균 배양 검사에서 Enterobacter cloacae가 검출되었으며, 봉합 부위의 피부 괴사가 진행되며 병변이 확대되는 소견이 관찰되었다(Fig. 2). 이후에도 여러 차례 변연절제술을 반복하였고, 최초로 병원에 내원한 지 2개월이 지난 시점에서 창상의 감염 소견이 호전되었다고 판단하여 부분층 피부 이식을 시행하였다(Fig. 3). 그러나 피부 이식 후 이식편의 약 50%는 생착하지 못하고 소실되었으며, 병변은 오히려 그 주변으로 확대되었다. 이에 첫 번째 피부 이식 4개월 후, 피부 결손 부위에 두 번째 부분층 피부 이식을 시행하였다(Fig. 4). 두 번째 피부 이식 후에도 괴사가 발생하여 병변 부위가 확대되고 극심한 통증이 지속되어 본원으로 전원되었다.
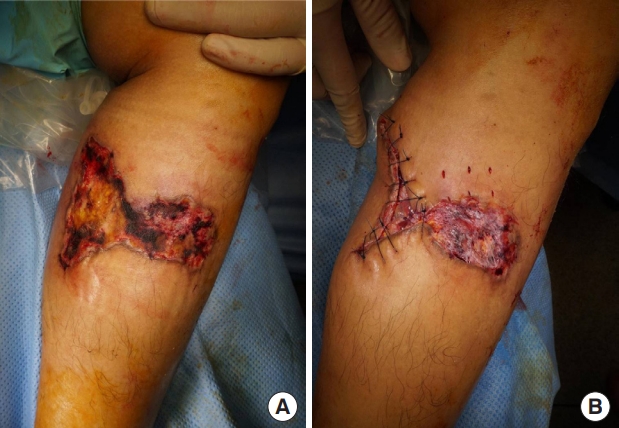
Photographs taken at a local hospital. (A) The wound was worsening when the patient first visited a local hospital 2 months after the wound occurred. (B) Wound debridement was done followed by partial suturing.
Photograph taken 2 weeks after the first debridement surgery. Suture site dehiscence and partial skin necrosis had developed.
Photograph of the first split-thickness skin graft (STSG). Serial wound debridement was implemented at the dehiscence site, after which a STSG was applied.
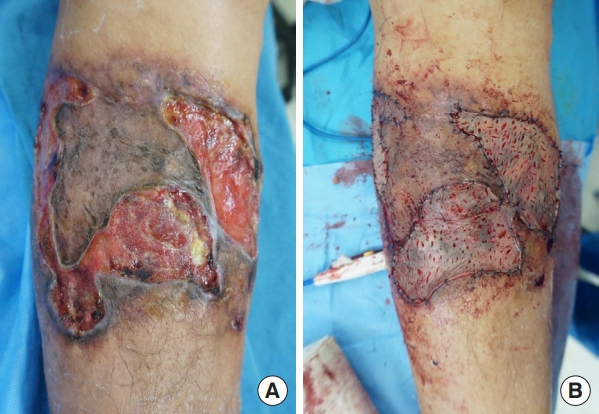
Photographs from 4 months after the first skin graft. (A) Approximately half of the split-thickness skin graft (STSG) failed to survive and the lesion was widened. (B) Second STSG surgery was performed.
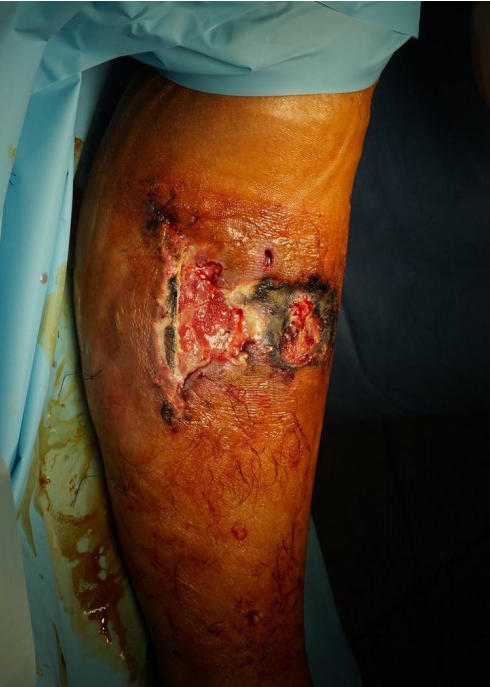
전원 당시에는 두 번째 피부 이식을 시행한 근위 및 원위부로 각각 15×11 cm, 10×7 cm과 오금 부위에 5×5 cm 크기의 적자색을 띤 불규칙한 경계를 가진 궤양성 병변이 관찰되었으며, 이 창상들은 시각 통증점수 7점의 심한 통증을 동반하고 있었다. 근위부의 안쪽 경계 일부에는 악취가 나는 분비물이 있어 세균 배양 검사를 시행하였다(Fig. 5). 발열 및 C반응단백 검사 등의 전신 감염을 의심할 만한 징후는 보이지 않았으며, 자기공명영상에서도 심부 근막 감염의 소견은 보이지 않았다. 병변 경계부에서 조직 검사를 실시하였는데 조직 검사를 시행한 부위에서 이상초과민 현상이 관찰되었다. 조직 검사 결과에서 조직 내 다수의 호중구 침윤 증가 소견이 관찰되었고 다른 질환을 의심할 만한 소견은 보이지 않았다. 세균 배양 검사에서 폐렴간균(Klebsiella pneumonia) 및 Serratia marcescens가 배양되어 항생제를 시프로플록사신(ciprofloxacin 400 mg 정주)으로 변경하였다. 혈액, 영상 및 내시경 검사를 해보았으나 류마티스 질환, 염증성 장 질환, 암 등과 같은 동반 질환을 시사할 만한 소견은 관찰되지 않았다. 저자들은 병력 및 검사 결과를 바탕으로 괴저고름피부증 진단을 의심하여 메틸프레드니솔론(methylprednisolone 60 mg 정주) 투여를 시작하였고, 기존 항생제를 유지하며 생리식염수를 이용한 병변 세척을 시행하였다. 고용량 스테로이드를 투여하기 시작한 지 3일 후 환부 통증이 저명하게 감소하였고, 감염이 없는 일부 경계면 부위에서 미세한 상피화 소견 등이 관찰되었다. 이를 토대로 면역 억제 치료가 효과가 있는 것으로 판단하고 표층 감염 부위와 괴사 조직에 대해 변연절제술을 부드럽게 시행하였다. 이와 동시에 변연절제술 후 발생한 일부 깊은 연부조직 결손에 대해 동종 진피 대체제(SureDerm, HansBiomed)를 적용하고, 전체 병변을 포함하도록 음압 창상 치료(CuraVAC, CGBio)를 적용하였다. 3-4일 간격으로 음압 드레싱을 교체하면서 병변이 호전되고 통증이 감소하여 입원 10일째 경 자가 부분층 피부 이식술을 권유했으나 이전에 피부 이식술이 실패한 기억과 공포감 때문에 환자가 거부하였다(Fig. 6). 이후 스테로이드의 감량을 시작하였으며 입원 후 4주가 지났을 때 10 mg/day 용량의 프레드니솔론(prednisolone)을 경구 투여로 변경하면서 퇴원하였다. 남은 병변의 드레싱은 폼 제재로 변경하여 외래 추시하였고 퇴원 3주 후 재발이나 악화 없이 창상들이 치유되었다(Fig. 7). 마지막 수술 후 6개월 뒤 최종 추시에서 재발 등의 특이 소견 없이 치유 부위가 잘 유지되고 있었다.
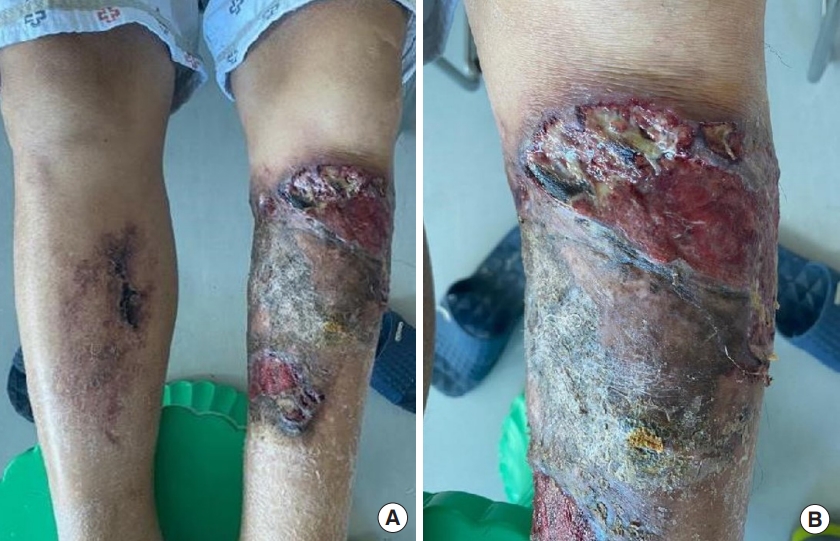
Photographs at the time of admission. (A) Necrotic and ulcerative lesions developed around the 2nd skin graft site. (B) Foul-smelling discharge was observed from portions of the ulcerative lesion.
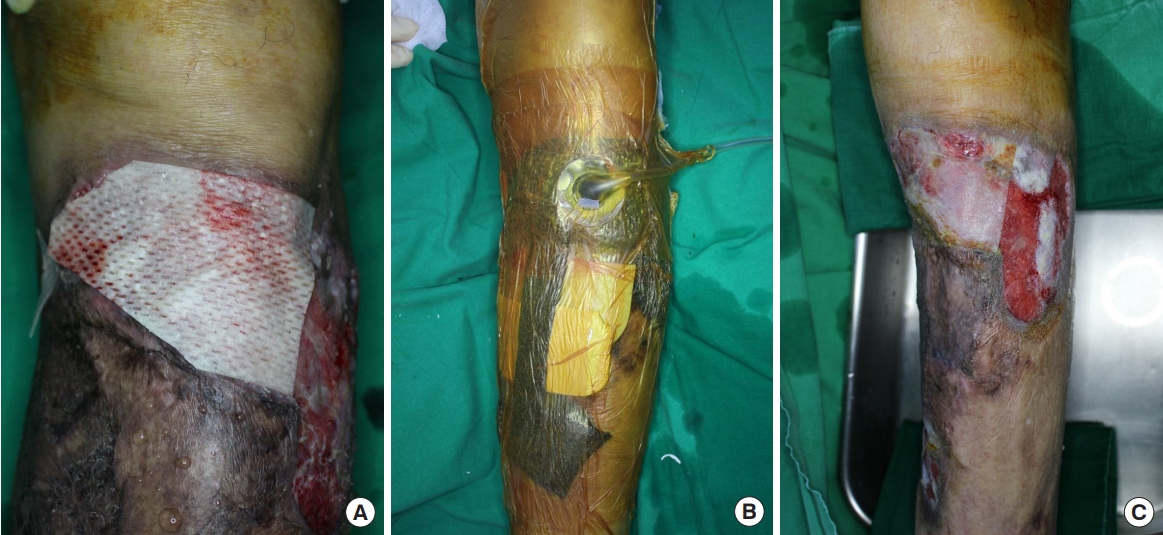
Intraoperative photographs taken. (A) After wound debridement, acellular dermal matrix (ADM) was applied. (B) Negative-pressure wound therapy was used on the wound after ADM application. (C) The wound shows improvement a week after ADM application.
고찰
괴저고름피부증은 1930년 Brunsting 등에 의해 처음으로 기술되었으며, 호중구 기능 장애, 염증 매개체 및 유전적 요인이 관여하는 다인성 질환으로 추정되고 있다[4]. 이 병은 여성에게서 남성보다 더 흔하며, 특히 40-50대에게 많이 발생한다고 알려져 있다. 병변은 하지에서 가장 흔히 발생하는 것으로 알려져 있다[5,6]. 사망률은 11%에서 17%로 알려져 있으며 주요 사망원인은 패혈증이다[7].
현재로서는 이 병의 확립된 진단 방법은 없으며, 주로 임상 배제 진단을 통해 진단된다[8]. 괴저고름피부증 환자의 30%에서 70%는 염증성 장 질환, 류마티스 관절염, 혈액암 등의 동반 질환을 가지고 있어, 치료 전에 이들에 대한 면밀한 조사가 필요하다[9]. Weenig 등[10]은 괴저고름피부증의 오진율이 10%에 이른다고 보고하였으며 감별해야 할 질환으로 혈관 폐쇄 또는 정맥 저류 질환, 혈관염, 피부 관련 악성 종양, 원발성 감염 그리고 기타 염증성 질환 등 6개의 카테고리를 제시하였다. 아울러 조직 검사를 반드시 시행하여 다른 질환의 가능성을 배제해야 한다고 강조하였다. 최근에는 Jockenhofer 등[11]이 하지에 발생한 60예의 괴저고름피부증 환자를 후향적으로 분석하여 병의 특징을 3개의 주요 기준(진행성 병변, 감별진단 평가, 적자색 창상 경계), 4개의 부기준(면역 억제제 투여에 따른 호전, 특징적으로 불규칙한 창상 모양, 외상 수상 부위에 발생하는 병변), 그리고 3개의 추가 기준(조직 검사상의 고름염증[suppurative inflammation], 창상 경계의 잠식[undermining], 전신 질환과의 연관)으로 분류하고 각 기준에 대해 3점, 2점, 1점을 부여해 10점 이상일 경우 괴저고름피부증 진단에 적합하다고 제안하였다. 하지만 이 진단 기준은 임상에서 좀 더 검증되어야 할 필요가 있다[8].
치료로는 고용량 스테로이드나 싸이클로스포린 등의 면역 억제 요법을 사용하는 내과적 치료가 주로 이루어지며 이상초과민 현상으로 인해 전통적으로 수술적 치료는 금기시되어 왔다. 그러나 진단 지연으로 인해 병변이 광범위해지거나 중복 감염이 동반된 경우에는 오히려 충분한 면역 억제 치료와 함께 시행하는 수술적 치료가 병변의 호전을 촉진하고 치료 기간을 단축하는 데 효과적이다. Eisendle 등[3]은 문헌 고찰을 통해 총 161예를 분석하였으며 면역 억제 치료와 함께 변연절제술 후 자가 피부 이식을 통해 치유 시간을 평균 4주로 단축시키고 감염과 같은 합병증 및 재발을 줄일 수 있다고 주장하였다. 본 증례에서도 전신 면역 억제 치료 시작 후 3일 뒤 환자의 통증이 확실하게 감소하고 감염이 없는 부위의 경계면에서 미세한 상피화 소견이 확인된 점을 근거로 이전의 문헌 보고에 따라 외과적 치료 시행을 결정하였다.
괴저고름피부증 치료에 있어 동종 또는 이종 진피 대체제 이식을 고려하는 경우는 병변이 깊고 넓거나 뼈나 힘줄 등이 노출되어 있어 자가 피부 이식이 어려운 경우, 또는 환자가 거부하는 경우이나 아직 확립된 적응증은 없다. Eisendle 등[3]은 돼지 이종 이식편을 이용한 2예의 치료 결과를 보고하며 통증 감소와 병변 환경 개선에 효과가 있음을 주장하였다. Dillingham과 Jorizzo [12]는 또한 호전이 더디며 비교적 깊이가 깊고 건이 노출된 병변에 대해 돼지 이종 이식편을 이용하여 치료한 증례를 보고하며 통증 감소와 병변의 평탄화에 효과가 있음을 주장하였다. 앞의 두 보고 모두 이식편이 세포외기질 비계(scaffold)로 작용하여 병변의 회복을 도모한다고 추론하고 있으나 명확한 기전을 밝히지는 못했다. 또한 3예 중 2예에서는 종국에 자가 피부 이식을 추가로 시행하여 치료를 종료하였다. 본 증례에서처럼 동종 진피 대체제만으로 병변을 치료한 보고는 국내에서 찾아보기 힘들며 해외 연구로는 2022년 Anaeme 등[13]이 동종 진피 대체제만으로 병변을 치료한 5예를 보고한 사례가 있다. 저자들은 동종 진피 대체제 이식이 병변의 치유를 촉진하며 자가 피부 이식 시 발생할 수 있는 초과민 현상 등의 합병증을 피할 수 있다고 주장하였다. 아울러 세포 성분이 제거된 동종 이식편이 면역 체계에 이상이 생긴 숙주에서 재혈관화에 더 유리할 것으로 추론하였으나 이는 좀 더 면밀한 임상 및 실험실 연구가 필요함을 강조하였다. 본 증례에서도 창상 기저부가 확실히 준비된 후 즉시 동종 진피 대체제를 적용하였다. 이는 연부 조직 결손 복구, 병변의 상피화 촉진 및 초기 음압 창상 치료 교체 시 발생하는 환부 통증 경감에 도움을 줄 수 있었다. 이식편이 성공적으로 안착한 경우 감염이 통제되었다고 판별할 수 있으며, 추후 필요시 시행될 자가 피부 이식술의 성공 여부도 미리 가늠해 볼 수 있다는 장점이있다.
하지에 발생하는 괴저고름피부증은 흔하지 않은 질환으로 오진 혹은 진단이 지연되는 경우 이환 기간이 길어지고 동반 감염 등의 합병증이 발생할 위험이 커진다. 이를 방지하기 위해 연부 조직 감염 등 다른 질환과의 감별 후 충분한 면역 억제 요법이 우선 시행되어야 한다. 이와 동시에 동종 진피 대체제를 이용한 외과적 치료를 통해 환부 통증 경감 및 공여 부위 이환 문제없이 비교적 깊은 연부 조직 결손의 복구를 촉진하여 치료 기간 단축 등의 효과를 얻을 수 있다.
Notes
이 논문에는 이해관계 충돌의 여지가 없음.